Tämä kirjoitus on ensimmäinen osa kirjoitussarjassani ”matala-asteinen tulehdus ja ravinto”. Ennen hyppäämistä ravitsemuksen kenttään katsaus siihen, mitä tulehdus on.
Matala-asteisen tulehduksen katsotaan olevan lähes kaikkien merkittävien kroonisten länsimaisia ihmisiä uhkaavien tautien takana. Toki, tulehduskaan ei ole ainoa syytekijä. Vuonna 2010 Science-lehti nimesi viime vuosikymmenen yhdeksi tärkeimmistä merkkipaaluista nimenomaan matala-asteisen tulehduksen ymmärtämisen (Insights of the decade. Science 2011;330:1612).
”Over the past decade, it has become widely accepted that inflammation is a driving force behind chronic diseases that will kill nearly all of us. Cancer. Diabetes and obesity. Alzheimer’s disease. Atherosclerosis. Here, inflammation wears a grim mask, shedding its redeeming features and making sick people sicker. ” Science -lehti 2010.
Jos jatkuvaa matala-asteista inflammaatiota voitaisiin jarruttaa tehokkaasti ruokavaliolla (aiheutamatta samalla muuta harmia kehossa), on todennäköistä, että samalla olisi keksitty tapa hidastaa syövän, diabeteksen, lihavuuden, Alzheimerin taudin ja sepelvaltimotaudin ja aivoinfarktien kehittymistä.
Tulehdus, kaksiteräinen miekka
Tulehdus on kehon luontainen puolustusreaktio ulkopuolisia uhkatekijöitä vastaan.
Tartuntatulehdus eli infektio johtuu ulkopuolisesta tunkeilijasta (mikrobista), kun taas ärsyttävä kudosreaktio eli inflammaatio voi johtua infektion lisäksi esim. vammasta (nilkan nyrjähdys), tuntemattomasta syystä (esim. reumassa) tai ravinnosta (esim. aterianjälkeinen tulehdusreaktio). Infektion aiheuttamassa tulehdusreaktiossa elimistö tappaa patogeenin ja aloittaa kudosta korjaavat prosessit sekä pyrkii rajaamaan infektion seuraamukset mahdollisimman pienelle alueelle. Vamman aiheuttamaa kudosärsytystä leimaa punoitus, turvotus, lämpö, kipu ja toiminnan vajaus. Matala-asteinen kytevä tulehdus ei kuitenkaan tunnu, eikä näy.
Tässä kirjoitussarjassa käsitellään nimenomaan ärsyttävää kudosreaktiota eli inflammaatiota. Tässä kirjoitussarjassa ei käsitellä infektion, mikrobien ja antibioottien merkitystä kroonisten sairauksien ehkäisyssä ja hoidossa.
- (Ärsytys)tulehdus kudostasolla = inflammaatio
- Bakteerin tai muun mikrobin aiheuttama tulehdus = infektio
Jatkuva kytevä hiljainen, siis matala-asteinen, tulehdus on elimistölle vaarallinen. Tällainen tulehdus voi aiheutua huonosta ja liiallisesta ravinnosta, tupakoinnista ja vaikkapa stressistä. Tyypillistä on, että näissä tapauksissa tulehduksen merkki-aineet eivät ole läheskään yhtä korkealla kuin vakavan infektion aikana.

Tulehdusprosessit ovat kaksiteräinen miekka. Mikrobi-infektiossa ehdottomasti avuksi, kroonisesti kytevänä kudosärsytyksenä haitaksi.
Tulehduksen mittareista tärkein CRP
Vielä muutama vuosikymmentä sitten tulehdusta mitattiin lähinnä senkan avulla. Senkka tai lasko kuvastaa kyllä kehossa olevaa tulehdusta, mutta se ei reagoi riittävän herkästi. Vaikka senkka on kunnossa kehossa voi muhia matala-asteinen tulehdus.
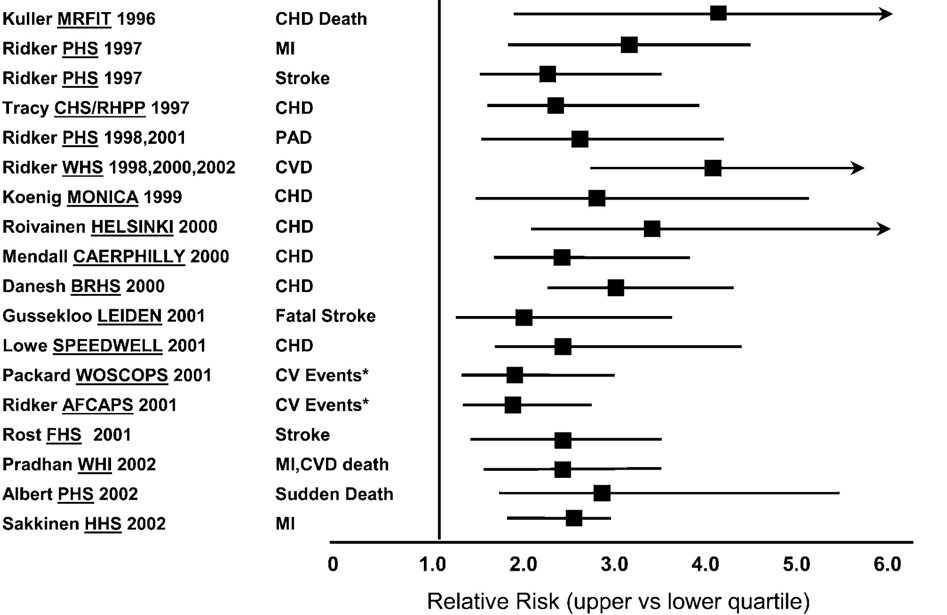
CRP on monien mielestä tärkein tulehdusta kuvaava suure ainakin sydän- ja verisuonitautien kannalta. CRP erittyy maksasta infektion, kudosärsytyksen (tulehduksen) tai vamman seurauksena. Lievästi jatkuvasti koholla olevan CRP:n mittaamiseen käytetään ns. herkän CRP:n mittaamismenetelmää (engl. hs-CRP). hs-CRP taitaakin olla ainoa tulehduksen mittari, jolla on voitu toistuvasti osoittaa olevan itsenäinen yhteys sydän- ja verisuonisairauksien ilmaantumiseen (kuva alla). Sitä käytetään laajasti kliinisessä työssä.
Muut tulehduksen mittarit
Tulehduksen mittareita on kymmeniä jos ei satoja, eikä loppua niiden löytämiselle taida olla näköpiirisssä. Suuri osa niistä ei ole kliinisessä käytössä.
CRP:n ohella mahdollisesti tärkeitä tulehduksen merkkiaineita ovat mm.:
- IL-6 , IL-1β , IL-12 a IL-18 (interleukiineja), jotka kuuluvat sytokiinien ryhmään
- TNF-α eli tuumorinekroosifaktori-alfa
- Endotoksiinit, kuten LPS (kts. alla)
- NKκ-B (nuclear factor κB ), liittynee erityisesti syövän ilmantuumiseen
- Amyloidi A, toimii monella tavoin kuten CRP, mutta saattaa olla herkempi reagoimaan kuin CRP
- Resistiini, (kuuluu adipokiineihin, kts. alla) voi kulkea myös nimillä ”dipose tissue-specific secretory factor (ADSF) tai C/EBP-epsilon-regulated myeloid-specific secreted cysteine-rich protein (XCP1)”
- V-CAM, erittyy verisuonten seinämistä
- I-CAM, ”
- P-selektiini, ”
- E-selektiini, ”
- PAI-1, ” lisää veren hyytymistä
- Typpioksidi, tietyin edellytyksin (lue tästä)
Tulehduksen vastavaikuttaja-aineiden mittaminen voi olla yhtä tärkeää kuin itse tulehduksen merkkiaineiden. Tulehdusta vastustavia merkkiaineita (siis hyödyllisiä) ovat esim.:
- Typpioksidi. Vain endoteelillä syntyvä ei-iNOS-välitteinen typpioksidi on tulehdusta vähentävä (kts. tästä)
- Il-8
- IL-10
- Adiponektiini, kuuluu adipokiineihin.
Edellisten merkkiaineiden lista ei ole tyhjentävä. Voidaan mm. perustellusti esittää, että HDL-kolesteroli on anti-inflammatorinen ja LDL-kolesteroli on inflammatorinen. En kuitenkaan käytä tässä kirjoitusarjassa kumpaakaan tulehduksen merkkiaineina.
Inflammaation, veren hyytymisen ja endoteelifunktion mittarit ovat osittain limittäisiä. Mittaria jota käytetään endoteelitoiminnan kuvaamiseen saatetaan käyttää myös inflammaation kuvaamiseen, ja päinvastoin. Veren hyytyminen eli tromboosi on myös keskeisesti sidoksissa inflammaatioon.
Tulehdus ja sydänkohtauksien synty
Käytän lähteenä Harvardin kardiologian professori Peter Libbyn kirjallisuuskatsausta vuonna 2006 American Journal of Clinical Nutrition -lehdessä. Siinä Libby esittelee tulehduksen ja sepelvaltimotaudin tai tarkemmin ateroskleroosin syntyä.
Ateroskleroosi alkaa usein endoteelin (valtimosuonen sisäpinta) tulehdusreaktiolla, jolloin endoteeli ryhtyy tuottamaan adheesiomolekyylejä kuten VCAM-1. VCAM-1 houkuttelee monosyyttejä, jotka kulkeutuvat endoteelin läpi valtimon seinämään ja lisäävät useiden erilaisten välittäjäaineiden (kemoattraktanttien) ilmaantumista. Valtimon seinämässä monosyytit muuttuvat makrofaageiksi, nielevät lipidejä (kuten hapettunutta LDL-kolesterolia) ja muuntuvat lopulta vaahtosoluiksi. Vaahtosolut ovat tyyppipiirre ateroskleroottisessa plakissa. T-solut hakeutuvat myös valtimon seinämään (intimaan), jossa ne vapauttavat inflammaatiota kiihdyttäviä sytokiinejä (interleukiineja). Tällä tavoin ateroskleroosin esiaste, rasvajuoste syntyy.
Tämän jälkeen inflammaatiolla on edelleen sormensa pelissä, kun rasvajuosteesta syntyy varsinainen suonen mahdollisesti tukkeuttava monimuotoinen plakki. Plakin kehittyessä, T-solut aktivoivat makrofageja joko soluvälitteisesti tai CD40 ligandikontaktin kautta erittämään runsaasti tulehdusaineita kuten sytokiineja ja kollageenia hajottavia aineita, kuten matriksi metalloproteinaaseja (MMP). Nämä yhdessä estävät suojaavan uuden kollageenin syntymistä plakin päälle ja samalla myös kiihdyttävät jo olemassa olevan kollageenin hajoamista. Näin plakin päällä oleva kollageenikerros heikkenee ja jää ohueksi, ja on atlis repeämään.
Lopuksi plakin revetessä plakkiin kertyneet T-solut liipaisevat liikkeelle hyytymisreaktion käskemällä makrofageja erittämään prokoagulanttia nimeltä kudosfaktori (Tissue Factor, TF). TF laittaa nopeasti aluelle veren hyytymiskaskaadin ja aiheuttaa verenhyytymän, joka voi johtaa sydäninfarktiin.
Libby selittää myös miten muuntunut LDL-kolesteroli on keskeisin lipidi rasvajuosteen ja plakin muodostumisessa. LDL:n tyypillisiä muuntumistapoja on joko hapettuminen (oksidaatio) tai sokeroituminen (glycation). Libbyn tarinan voisi tiivistää seuraaviin seikkoihin:
- Inflammaatiotekijät, erityisesti VCAM-1, sysää verisuonten sisäpinnalla alulle monimutkaisen muuntunutta LDL-kolesterolia kerryttävän prosessin. Tämän prosessin seurauksena syntyy plakki, ja valtimo kaventuu
- Inflammaatiotekijät ohentavat plakin päällä olevaa kollageenikerrosta, minkä vuoksi plakki on heikko ja repeää helposti
- Repeytyneen plakin kohtaan syntyy helposti tukkeuma, koska repeytyvän plakin makrofaagit vapauttavat runsaasti kokkaroitumista edistävää ainetta kudosfaktoria (Tissue Factor, TF), joka liipaisee alulle veren hyytymiskaskaadin
Tulehduksen jäljet näkyvät, missä polttopiste?
Tulehdusta voidaan siis mitata erilaisilla tulehduksen merkkiaineilla. Osa tulehduksen merkki-aineista erittyy maksasta, osa suoraan tulehtuneesta kudoksesta ja osa tulehdussoluista kuten makrofageista ja T-souluista. Esimerkiksi verisuoni voi erittää verenkiertoon suoraan tulehduksen merkkiaineita, kuten I-CAM, V-CAM, E- ja P-selektiini (kuva).
Tulehdus voi olla lähtöisin myös esim. suolistosta, iholta, keuhkoista tai nivelistä, eli tulehduksen polttopiste voi olla eripuolella kehoa. Kohonnut CRP ei vielä kerro missä kehon osassa polttopiste on. Ateroskleroosissa polttopisteenä on verisuonen seinämä, ja erityisesti sen sisin kerros endoteeli ja seuraava kerros eli intiima.
Yleisesti ajatellaan niin, että jos CRP on kohonnut kyse on pahemmasta tulehduksesta, kuin silloin kun se ei ole. Tulehdusta voi pitää yllä myös lisääntynyt rasvakudoksen määrä kehossa (kuva). Suolistosta peräisin olevasta tulehduksesta seuraavassa kappaleessa.
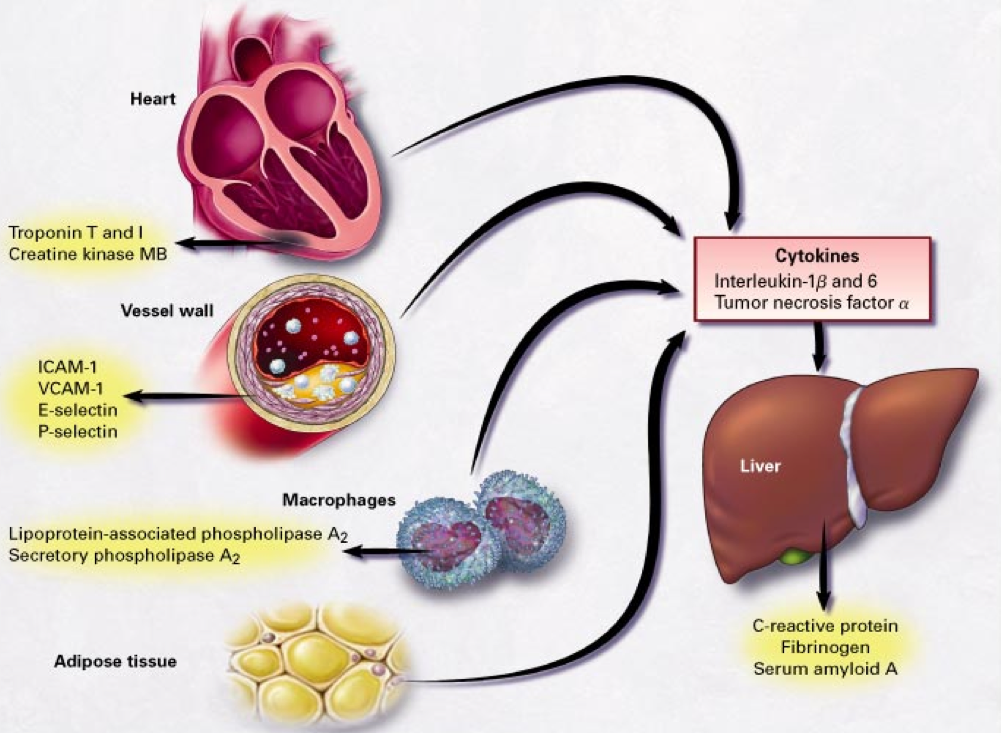
Matala-asteisen tulehduksen merkkiaineet voivat olla peräisin useista elimistä. Kuvasta puuttuu esim. suolisto, nivelet, keuhkot ja iho. Lähde: Rader et al. NEJM 2000;343:1179-1182
Suoliston endotoksiinit, LPS
Inflammaation merkki-aineiden nousu voi saada alkunsa myös suolistosta. Kohtalaisen uusi ja tärkeä käsite on ns. metabolinen endotoksemia. Seuraavassa tarkemmin tästä ilmiöstä.
Kuten useimmille on tuttua suolistossamme, etupäässä paksusuolessa, majailee hillitön määrä baktereita, sekä elimistölle edullisia että haitallisia. Näistä bakteereista osa, tarkemmin sanoen gram-negatiivisten bakteerien joukkoon kuuluvat, erittävät kuollessaan bakteerisolun sisäistä voimakasta tulehdusta lisäävää ainetta lipopolysakkaridia (LPS). Suolistossa kuolee (ja syntyy jakautumalla) jatkuvasti bakteereita. LPS:ää voidaan ruiskuttaa koe-eläimeen ja näin aiheuttaa nopeasti kokeellinen suoliston ja elimistön tulehdustila.
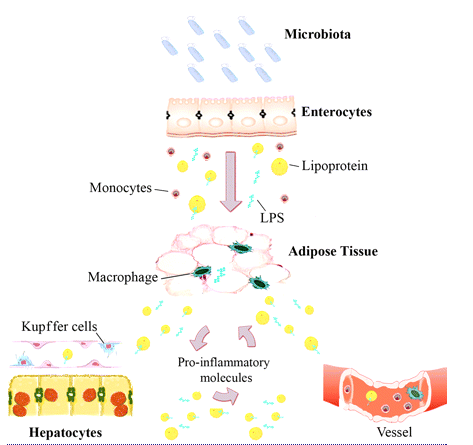
LPS on tulehdusta aiheuttava endotoksiini, joka vapautuu suoliston gram-negatiivista bakteereista ja vaikutaa laajalti elimistön inflammaatioprosesseihin. Lähde: Manco et al. 2010
LPS imeytyy suolistosta kylomikronien avulla lymfanesteeseen ja sitä kautta edelleen verenkiertoon, missä lipoproteiinit kuljettavat sitä eteenpäin verisuonten endoteelille, rasvasoluille (adiposyyteille) ja maksasuoluille. Tämän jälkeen ne aiheuttavat tulehdusreaktion verisuonissa, maksassa ja rasvakudoksessa.
LPS:n määrää veressä säätelee ainakin gram-negatiivisten solujen kuolema (bakteeritasapaino suolessa) ja LPS:n imeytyminen. Ravinnolla ja ravintolisillä voidaan vaikuttaa sekä LPS:n imeytymiseen ja aktivaatioon että mahdollisesti myös LPS muodostumiseen suolistossa.
LPS:n määrä veressä (tai muualla kehossa) on siten yksi keskeinen tulehduksen merkki-aine.
Tilanteita joissa tulehdusarvot ovat koholla
Tämän kirjoitussarjan ulkopuolelle jäävistä seikoista kannattaa mainita muutama, joilla on selkeä merkitys tulehdusarvoihin. Mainitsen tässä ne tässä siksi, että ne voivat olla sekoittavia tekijöitä, kun arvioidaan eli ruokavaliotekijöiden osuutta matala-asteisessa tulehduksessa.
Raskas liikunta, akuutti vaikutus
Liikunta lisää tulehduksen merkiaineita akuutisti (joitakin tunteja liikunnan jälkeen), mutta säännöllinen liikunta puolestaan vähentää tavanomaisia tulehdusmerkkiaineiden tasoja. Tämä voi olla yksi niistä syistä, miksi säännöllinen liikunta näyttää suojaavan sydäntapahtumilta vaikka sen avulla liikapaino ei vähenisikään. On siis tärkeä kiinnittää huomiota paitsi akuuttiin tulehdusvaikutukseen myös pidemmän aikavälin tuelhdustekijöihin. Ne voivat olla ristiriidassa. Kasapis & Thompson 2005
Joissakin ruokavaliointerventioissa liikunta on yksi komponentti laajempaa elämäntaparemonttia, ja tämä on huomioitava tuloksia tulkittaessa.
Lihavuus- ja laihduttaminen
Lihavuus on krooninen matala-asteisen tulehduksen leimaama tila. Lihavuus heijastuu useisiin tulehduksen merkkiaineisiin.
Monet tietävät ohjelman Amerikkalaisen ohjelmaformaatin Biggest Loser. Tähän ohjelmasarjaan osallistuneita laihduttajia tarkemmin tutkiessa havaitiin, että erittäin massiivinen (-39 % painosta) laihduttaminen vähentää CRP:tä noin 80 % ja muitakin tulehdusmittareita. Toisaalta tiedetään, että aina edes 10 % laihduttaminen ei vähennä inflammaatiota, vaikka 10 %:n laihtumista on pidetty jonkinasteisena minimirajana tulehduksen vähentymiselle.
Painon pudotuksen tehokkuus vaikuttaa inflammaatioon, ruuan laadun ja määrän ohella.
Stressi
Stressin on todettu sekä väestötutkimuksissa että koe-eläinmalleissa lisäävän erilaisten tulehdusmerkki-aineiden määrää veressä. Jatkuva psykososiaalinen stressi on yhteydessä sydän- ja verisuonisairauksiin, ja yksi mahdollinen selittävä tekijä onkin nimenomaan inflammaatio. Stressi näyttää aktivoivan erityisesti NKκ-B -välitteistä tulehdustietä. Kiecolt-Glaser 2010
Joissakin ruokavaliotutkimuksissa on myös integroitua stressinhallintaa.
Unenpuute
Laboratorio-olosuhteissa on voitu osoittaa, että unenpuute heijastuu useiden tulehdussytokiinien määrään veressä. Lisäksi näyttää siltä, että jatkuvasta unettomuudesta ja uniapnesta kärsivillä on koholla olevat inflammaatioarvot. Motivala 2011
Lopuksi
Matala-asteinen tulehdus on monimutkainen prosessi, tässäkin kirjoituksessa sitä lähestyttiin suppeasti ateroskleroosin kannalta. Syövän ja inflammaation yhteydet ovat tietenkin osittain poikkeavia ja niitä voi opiskella vaikka tästä katsauksesta. Muistihäiriöistä ja inflammaatiosta enemmän tässä katsauksessa.
Seuraava osa käsittelee ravinnon rasvoja ja tulehdusta. Jatko-osissa pureudutaan lähinnä niihin tulehduksen merkkiaineisiin, jotka tässä on esitelty.
Lähteet
Federico et al. Fat: a matter of disturbance for the immune system. World J Gastroenterol. 2010 Oct 14;16(38):4762-72
Goldberg. Cytokine and Cytokine-Like Inflammation Markers, Endothelial Dysfunction, and Imbalanced Coagulation in Development of Diabetes and Its Complications. J Clin Endocrinol Metab 2009:94;3171-3182
Hanson. Inflammation, Atherosclerosis, and Coronary Artery Disease. NEJM 2005; ;352:1685-95.
Kasapis & Thompson. The Effects of Physical Activity on Serum C-Reactive Protein and Inflammatory Markers. A Systematic Review. J Am Coll Cardiol, 2005;45:1563-1569
Kiecolt-Glaser. Stress, Food, and Inflammation: Psychoneuroimmunology and Nutrition at the Cutting Edge. Psychosomatic Medicine 72:365–369 (2010) 369
Libby. Inflammation and cardiovascular disease mechanisms. Am J Clin Nutr 2006;832:456S-460S
Libby. Atherosclerosis, the new view. Scientific American 2002, May, p. 47-55.
Libby. Inflammation in Atherosclerosis. From Pathophysiology to Practice. J Am Coll Cardiol 2009; 54:2129-2138
Manco et al. Gut microbiota, lipopolysaccharides, and innate immunity in the pathogenesis of obesity and cardiovascular riskEndocr Rev. 2010 Dec;31(6):817-44
Motivala. Sleep and inflammation: psychoneuroimmunology in the context of cardiovascular disease. Ann Behav Med. 2011 Oct;42(2):141-52.
Rader. Inflammatory Markers of Coronary Risk. N Engl J Med 2000; 343:1179-1182
Singh & Newman. Inflammatory markers in population studies of aging. Ageing Res Rev. 2011 Jul;10(3):319-29.